腫瘤細(xì)胞衍生的細(xì)胞外囊泡(EV)正在作為循環(huán)生物標(biāo)志物進(jìn)行探索�����,但尚不清楚批量測(cè)量是否可以進(jìn)行早期癌癥檢測(cè)����。來(lái)自哈佛醫(yī)學(xué)院的Ralph Weissleder教授團(tuán)隊(duì)在Science Advances雜志發(fā)表文章����,研究發(fā)現(xiàn)單EV分析(sEVA)技術(shù)可提高癌癥診斷的準(zhǔn)確性。

胰腺導(dǎo)管腺癌(PDAC)目前是癌癥死亡的重要原因之一�����。治愈胰腺癌的唯一方法是在它仍然在局部時(shí)通過(guò)手術(shù)切除它。在目前的治療模式下�,只有20%的患者可手術(shù),而40%的患者會(huì)出現(xiàn)局部但手術(shù)無(wú)法切除��,而其余的40%的患者會(huì)出現(xiàn)轉(zhuǎn)移����。盡管有最先進(jìn)的計(jì)算機(jī)斷層掃描(CT)、磁共振成像(MRI)和超聲內(nèi)鏡對(duì)“影像學(xué)發(fā)現(xiàn)的局部疾病”和接受手術(shù)的患者進(jìn)行手術(shù)��,但切緣的病理陽(yáng)性率為40%至70%��,并且胰周淋巴結(jié)病變病理陽(yáng)性率為60%~80%��。如果我們要治愈更多的胰腺癌患者�����,就需要新的診斷工具來(lái)識(shí)別患有臨床前和真正局部疾病的患者����,并探索新的治療方法以允許更多的R0/N0切除。
高分辨率��、對(duì)比增強(qiáng)CT和MRI成像是常做的檢查,但它們?cè)跈z測(cè)微小疾病方面的敏感性通常受到限制���,特別是在新輔助和術(shù)后環(huán)境中���。技術(shù)進(jìn)步繼續(xù)快速提高檢測(cè)血液樣本中循環(huán)生物標(biāo)志物的能力��。這些“液體活檢”標(biāo)志物包括突變或甲基化無(wú)細(xì)胞DNA(cfDNA)���、腫瘤相關(guān)細(xì)胞外囊泡(EV)�、循環(huán)腫瘤細(xì)胞和代謝參數(shù)(例如�����,糖尿病和肌肉萎縮)�。盡管EV、cfDNA和代謝標(biāo)志物已經(jīng)顯示出用于PDAC診斷的前景����,但它們目前的檢測(cè)靈敏度需要進(jìn)一步改進(jìn)才能在臨床上有用。特別是在疾病早期���,較低的診斷準(zhǔn)確性可能是由于PDAC的大量基質(zhì)成分����、與無(wú)腫瘤胰腺炎無(wú)法區(qū)分的胰腺炎局灶區(qū)域共存以及早期循環(huán)生物標(biāo)志物數(shù)量少。
研究人員已經(jīng)開(kāi)發(fā)了許多分析EV的方法�。許多早期技術(shù)依賴(lài)于批量測(cè)量,單次測(cè)量需要102到106個(gè)EV��。雖然單EV方法[用多熒光���、單粒子干涉反射熒光成像�、納米粒子跟蹤分析����、微流體電阻脈沖傳感和納米流式細(xì)胞術(shù)進(jìn)行單EV分析(sEVA)]正在積極開(kāi)發(fā)中,但它們測(cè)量不同的參數(shù)(通常是大小而不是比分子生物標(biāo)志物)��。不管具體的物理測(cè)量如何����,下一個(gè)問(wèn)題是要分析哪種分子生物標(biāo)志物。雖然研究仍在進(jìn)行中����,但很明顯,許多描述的生物標(biāo)志物在更大的臨床驗(yàn)證隊(duì)列中都失敗了�����。因此出現(xiàn)的一個(gè)關(guān)鍵問(wèn)題是,這種失敗是否是由于選擇了給定的分子生物標(biāo)志物����、PDAC的極端異質(zhì)性,或者無(wú)法準(zhǔn)確檢測(cè)正常EV群體中極少量的生物標(biāo)志物陽(yáng)性EV��。
作者認(rèn)為�,解決當(dāng)前問(wèn)題的一種方法是進(jìn)行sEVA�,因?yàn)榕糠椒赡軣o(wú)法在宿主EV的背景下識(shí)別少量起源于腫瘤的EV(例如在微觀癌癥中發(fā)現(xiàn)的那些)。進(jìn)一步假設(shè)突變的癌蛋白(例如����,KRASmut)或腫瘤抑制基因(例如,P53mut)可以在單個(gè)EV中檢測(cè)到���,而癌細(xì)胞中發(fā)生的相同突變是腫瘤EV脫落增加的原因����。檢測(cè)這些突變蛋白質(zhì)的選擇也受到它們?cè)赑DAC發(fā)展級(jí)聯(lián)中的早期出現(xiàn)的驅(qū)動(dòng)���。最后�����,作者推斷可以通過(guò)對(duì)幾種生物標(biāo)志物進(jìn)行多重測(cè)量來(lái)提高檢測(cè)效率��。在這些范例的基礎(chǔ)上��,開(kāi)發(fā)并驗(yàn)證了一種強(qiáng)大的sEVA技術(shù)��,該技術(shù)允許在單個(gè)EV中進(jìn)行多重蛋白質(zhì)測(cè)量�����。sEVA技術(shù)可解答如下問(wèn)題:(i)EV中假定的癌細(xì)胞相關(guān)蛋白的固有異質(zhì)性是什么����,(ii)單個(gè)EV中突變的腫瘤/腫瘤抑制蛋白的頻率是多少,以及(iii)單個(gè)EV上兩種或多種癌癥相關(guān)蛋白的表達(dá)水平是多少���?通過(guò)非重疊標(biāo)記“覆蓋”更多腫瘤衍生的EV(tEV)或獲得“高度特異性”的EV鑒定(如KRASmut和P53mut)是改善臨床PDAC診斷的可靠選擇���。
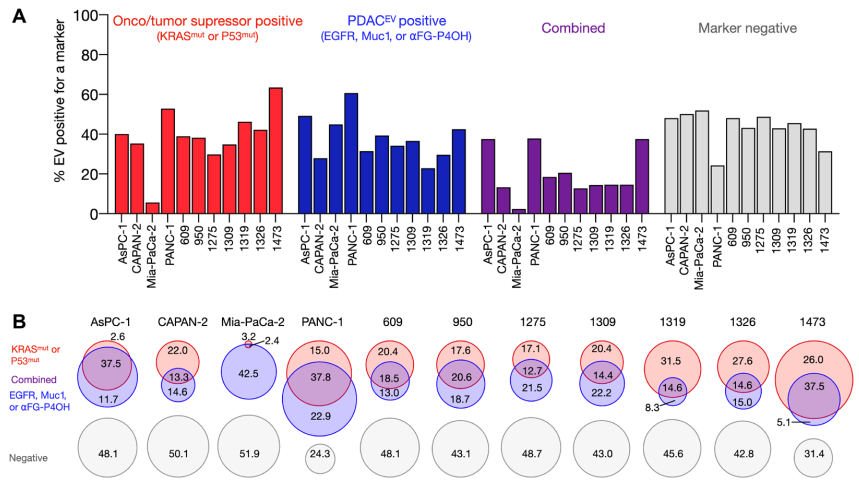
多個(gè)PDAC細(xì)胞系衍生EV的sEVA分析
使用胰腺癌(PDAC),作者分析了11個(gè)細(xì)胞系中推定的癌癥標(biāo)志物的組成����。在KRASmut和/或P53mut蛋白陽(yáng)性的親代PDAC細(xì)胞中�,只有約40%的EV也是陽(yáng)性的��。
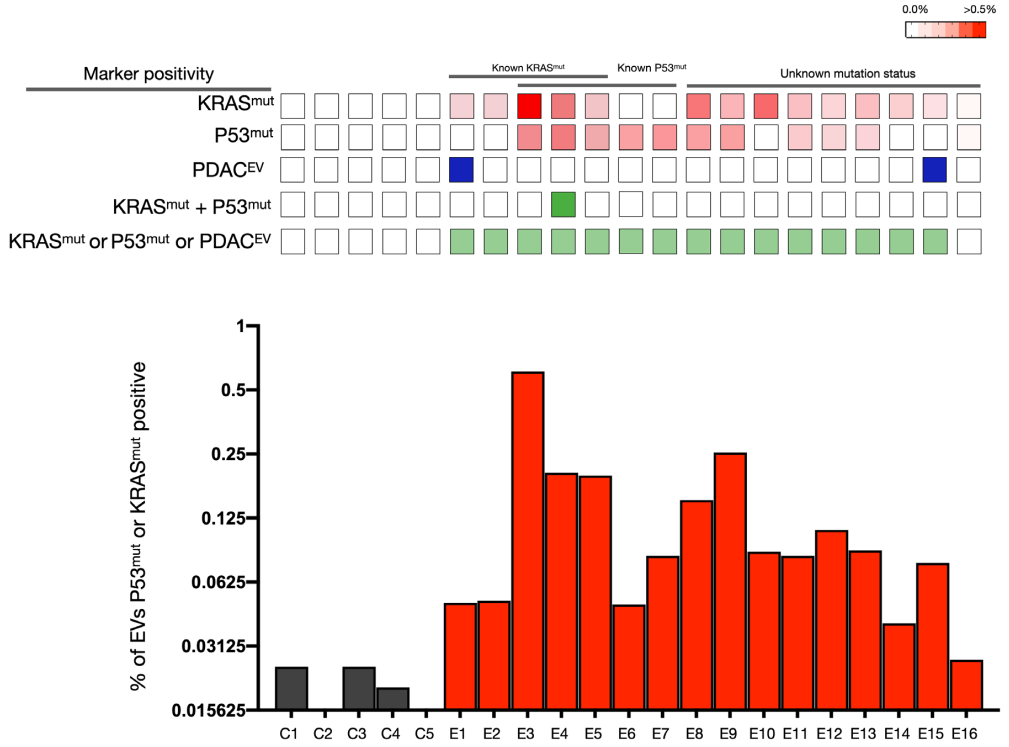
臨床1期PDAC病例的sEVA分析結(jié)果
在一項(xiàng)涉及16名經(jīng)手術(shù)證實(shí)為1期PDAC患者的盲法研究中�,可檢測(cè)到KRASmut和P53mut蛋白的水平要低得多,通常在<0.1%的囊泡中(即���,患者樣本中陽(yáng)性囊泡占比通常<0.1%)���。16名患者中有15名可通過(guò)新的sEVA方法檢測(cè)到這些囊泡。
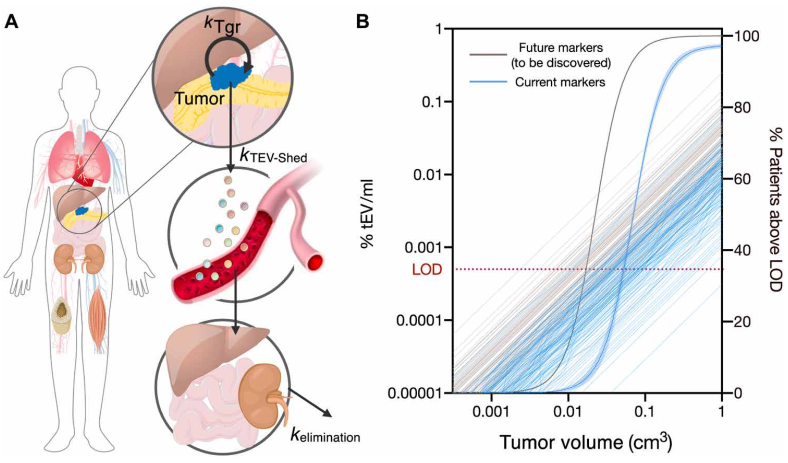
使用血漿sEVA對(duì)PDAC癌癥檢測(cè)進(jìn)行建模
使用建模方法�,作者估計(jì)基于單EV分析(sEVA)技術(shù)的PDAC檢測(cè)限約為0.1-cm3腫瘤體積,優(yōu)于臨床成像能力��。這些發(fā)現(xiàn)確立了sEVA用于早期癌癥檢測(cè)的潛力���。
參考文獻(xiàn):
FergusonS, Yang KS, Zelga P, Liss AS, Carlson JCT, Del Castillo CF, Weissleder R. Single-EVanalysis (sEVA) of mutated proteins allows detection of stage 1 pancreaticcancer. Sci Adv. 2022 Apr 22;8(16):eabm3453. doi:10.1126/sciadv.abm3453. Epub 2022 Apr 22. PMID: 35452280.
分子細(xì)胞生物學(xué)實(shí)驗(yàn)
輝駿實(shí)力












 實(shí)驗(yàn)熱線:4006991663
實(shí)驗(yàn)熱線:4006991663