了解與研究蛋白質(zhì)間的相互作用(Protein-Protein Interaction, PPI),是理解細(xì)胞內(nèi)發(fā)生若干生物化學(xué)活動(dòng)的第一步�。在眾多的PPI研究方法中��,通常將蛋白質(zhì)分為誘餌蛋白與獵物蛋白��,利用酵母的生長(zhǎng)(Y2H)���,觀察活體細(xì)胞中的熒光(熒光能量轉(zhuǎn)移����,F(xiàn)luorescence Resonance Energy Transfer�����,F(xiàn)RET或雙分子熒光互補(bǔ)�����,Bimolecular Fluorescent Complementation�,BiFC)以及采用各類體內(nèi)與體外的沉淀法(免疫沉淀或親和純化等)等方法,檢測(cè)誘餌蛋白與獵物蛋白之間的相互作用【1】��。
難以避免的是���,每種方法都具有局限性��,必須基于一種以上的PPI方法�,才可以得出可信的結(jié)果【1】����。雖然,這些方法都在植物PPI的研究中較為廣泛的應(yīng)用�,但是,我們?nèi)孕枰l(fā)展新的PPI方法��,尤其能夠解決現(xiàn)有方法的局限性���。雷帕霉素(Rapamycin)作為一種化學(xué)分子�����,能夠介導(dǎo)分別含有FKBP(FK506-Binding Protein)結(jié)構(gòu)域與FRB(FKBP-Rapamycin-Binding)結(jié)構(gòu)域的蛋白形成異二聚體�。雷帕霉素與FKBP結(jié)構(gòu)域結(jié)合形成復(fù)合體,并進(jìn)一步與FRB結(jié)構(gòu)域結(jié)合��。
利用這一特性���,前人在人類細(xì)胞中創(chuàng)建了用于研究蛋白功能的Knocksideways系統(tǒng)【2】�����。將線粒體定位信號(hào)���、熒光蛋白與FRB結(jié)合為線粒體錨定蛋白(圖1,綠色蛋白)���,同時(shí)��,將待檢測(cè)蛋白與FKBP結(jié)構(gòu)域相連(圖1����,紅色蛋白)���,在施加雷帕霉素后��,待檢測(cè)蛋白會(huì)重定位于線粒體中����。由于待檢測(cè)蛋白的非正常定位����,無法發(fā)揮其功能,配合其他檢測(cè)方法可以研究其功能【2】����,可用于研究對(duì)象突變體致死的環(huán)境下。雷帕霉素能夠形成二聚體的作用已經(jīng)在不同類型的生物體中得以應(yīng)用【3-5】�,但少見于植物細(xì)胞中【1】。
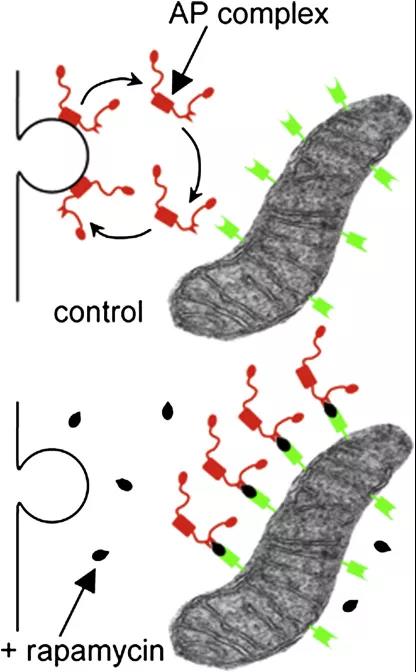
圖1 Knocksideways系統(tǒng)【2】
|
|
2021年1月25日��,來自比利時(shí)根特大學(xué)Dani?l Van Damme團(tuán)隊(duì)在 The Plant Cell發(fā)表了題為Visualizing protein-protein interactions in plants by rapamycin-dependent delocalization的研究論文�����。該研究利用雷帕霉素能夠調(diào)控異二聚體在細(xì)胞內(nèi)的形成這一過程��,創(chuàng)建若干不同細(xì)胞結(jié)構(gòu)定位信號(hào)的FRB融合蛋白���,利用熒光共聚焦顯微鏡�,選取已知互作蛋白,驗(yàn)證并建立����,可應(yīng)用于植物細(xì)胞中的KSP(Knocksideways in plants)蛋白互作檢測(cè)系統(tǒng),并且探討了其適用性與局限性����,提出了進(jìn)一步改進(jìn)的方法。
在該研究中�����,作者基于Knocksideways系統(tǒng)【2】�����,結(jié)合已知的研究結(jié)果�����,利用MultiSite Gateway技術(shù)��,創(chuàng)建了融合不同細(xì)胞結(jié)構(gòu)定位信號(hào)的FRB蛋白(定位信號(hào)-熒光分子-FRB)����,包括微管���、細(xì)胞核、線粒體以及細(xì)胞膜�。在熒光共聚焦顯微鏡的觀察下,煙草表皮細(xì)胞中���,連接不同信號(hào)分子的FRB融合蛋白都能夠定位于相應(yīng)的細(xì)胞結(jié)構(gòu)上�����。作者進(jìn)一步,將細(xì)胞結(jié)構(gòu)定位與FRB融合蛋白不同的誘餌蛋白�����,連接 FKBP蛋白(誘餌蛋白-mCherry-FKBP或FKBP-mCherry-誘餌蛋白)����,共同在煙草中表達(dá)兩個(gè)融合蛋白。施用雷帕霉素后��,融合FKBP的誘餌蛋白在雷帕霉素的作用下�,重新定位于含有FRB融合蛋白的細(xì)胞結(jié)構(gòu)上。至此��,驗(yàn)證了雷帕霉素在植物細(xì)胞中,能夠介導(dǎo)異二聚體形成�。在此基礎(chǔ)上,作者利用已知的蛋白相互作用�,將獵物蛋白與GFP蛋白相連,在施加雷帕霉素后����,獵物蛋白與誘餌蛋白能夠共定位在特定細(xì)胞結(jié)構(gòu)上。比如����,利用KSP系統(tǒng),重現(xiàn)了SACL蛋白與LHW蛋白的互作【6】���。
在雷帕霉素處理后�����,熒光信號(hào)位于細(xì)胞核中的SACL-GFP與LHW-mCherry-FKBP��,轉(zhuǎn)移到了線粒體上��,與線粒體定位的MITO-TagBFP2-FRB信號(hào)重疊�?��;谝陨辖Y(jié)果�����,表明KSP系統(tǒng)具有可誘導(dǎo)性����。此外,為了探討KSP的可逆性與穩(wěn)定性�,作者引入了雷帕霉素的拮抗物子囊霉素(Ascomycin),其能夠競(jìng)爭(zhēng)性結(jié)合FKBP結(jié)構(gòu)域【7】�����。實(shí)驗(yàn)結(jié)果表明���,在雷帕霉素處理后,5分鐘內(nèi)就可以觀察到熒光信號(hào)的重定位現(xiàn)象��。在此基礎(chǔ)上���,再經(jīng)歷子囊霉素處理�����,熒光信號(hào)重定位現(xiàn)象仍然能在24小時(shí)后觀察到���。為了對(duì)蛋白質(zhì)重定位進(jìn)行定量分析��,作者也提供了基于ImageJ/Fiji軟件的腳本與操作手冊(cè)�����,在圖片標(biāo)準(zhǔn)化處理后���,配合腳本實(shí)現(xiàn)了圖片批量處理,可以對(duì)施加雷帕霉素前后����,熒光信號(hào)位置變化進(jìn)行相對(duì)定量。隨后����,作者也探討了KSP的局限性。在該系統(tǒng)中�����,定位于細(xì)胞核中的KRP2蛋白,在雷帕霉素處理后����,無法觀察到較為明顯的重定位現(xiàn)象。
最后�����,作者探討了KSP系統(tǒng)的前景與改進(jìn)方向�。比如兩個(gè)以上蛋白間的相互作用,特定細(xì)胞區(qū)域中酶促反應(yīng)研究與條件性“敲除”基因等���。在改進(jìn)方向上����,提出通過引入組織特異性啟動(dòng)子�,或?qū)⒍鄠€(gè)表達(dá)框整合到同一載體上等方法��,有望拓展KSP系統(tǒng)的適用性��。
總而言之�����,基于文章中實(shí)驗(yàn)結(jié)果�����,KSP系統(tǒng)是一個(gè)在植物細(xì)胞中研究蛋白質(zhì)相互作用的有力工具。作者通過改進(jìn)Knocksideways系統(tǒng)【2】���,使之較為系統(tǒng)性地應(yīng)用于植物細(xì)胞中PPI研究�����,相比較于其他適用于植物細(xì)胞中的系統(tǒng)具有特定優(yōu)勢(shì)�����。1. 雷帕霉素施用與否�,本身可以作為實(shí)驗(yàn)對(duì)照����。在施用后,極短時(shí)間內(nèi)就能觀測(cè)到結(jié)果�����,且可持續(xù)至24小時(shí)����。2. KSP相較于BiFC與FRET����,其相互作用結(jié)果讀取�����,并不依賴熒光基團(tuán)的互補(bǔ)或基團(tuán)之間的空間距離���。但是����,KSP系統(tǒng)在檢測(cè)蛋白互作中具有一定的局限性�����。相對(duì)于可移動(dòng)性較高的蛋白(如定位于微管與細(xì)胞質(zhì))���,或具有多種亞細(xì)胞定位的蛋白�,有特定且穩(wěn)定分布的蛋白(比如位于細(xì)胞核的KRP2)�, KSP的作用不明顯��。再者,KSP表現(xiàn)出可以檢測(cè)兩個(gè)以上蛋白的相互作用����,但無法了解第三個(gè)蛋白是促進(jìn)或競(jìng)爭(zhēng)結(jié)合。有需要的讀者�,可以參考近期發(fā)表在Plant Physiology上利用酵母,檢測(cè)第三個(gè)蛋白如何調(diào)控蛋白互作的Tri-SUS系統(tǒng)【8】��。
參考文獻(xiàn)
1. Struk, S., Jacobs, A., Sánchez Martín-Fontecha, E., Gevaert, K., Cubas, P., & Goormachtig, S. (2019). Exploring the protein-protein interaction landscape in plants. Plant, cell & environment, 42(2), 387–409.
2. Robinson, M. S., Sahlender, D. A., & Foster, S. D. (2010). Rapid inactivation of proteins by rapamycin-induced rerouting to mitochondria. Developmental cell, 18(2), 324–331.
3. Putyrski, M., & Schultz, C. (2012). Protein translocation as a tool: The current rapamycin story. FEBS letters, 586(15), 2097–2105.
4. Hughes, K. R., & Waters, A. P. (2017). Rapid inducible protein displacement in Plasmodiumin vivo and in vitro using knocksideways technology. Wellcome open research, 2, 18.
5. Wood, L. A., Larocque, G., Clarke, N. I., Sarkar, S., & Royle, S. J. (2017). New tools for "hot-wiring" clathrin-mediated endocytosis with temporal and spatial precision. The Journal of cell biology, 216(12), 4351–4365.
6. Vera-Sirera, F., De Rybel, B., úrbez, C., Kouklas, E., Pesquera, M., álvarez-Mahecha, J. C., Minguet, E. G., Tuominen, H., Carbonell, J., Borst, J. W., Weijers, D., & Blázquez, M. A. (2015). A bHLH-Based Feedback Loop Restricts Vascular Cell Proliferation in Plants. Developmental cell, 35(4), 432–443.
7. Li, J. F., Bush, J., Xiong, Y., Li, L., & McCormack, M. (2011). Large-scale protein-protein interaction analysis in Arabidopsis mesophyll protoplasts by split firefly luciferase complementation. PloS one, 6(11), e27364.
8. Zhang, B., Xia, L., Zhang, Y., Wang, H., & Karnik, R. (2020). Tri-SUS: A Yeast Split-Ubiquitin assay to examine protein interactions governed by a third binding partner. Plant Physiology. kiaa039.
 實(shí)驗(yàn)熱線:4006991663
實(shí)驗(yàn)熱線:4006991663













