2米長(zhǎng)的DNA如何裝進(jìn)直徑只有10微米的細(xì)胞核�����?我們體內(nèi)幾乎所有的細(xì)胞都完美解決了這個(gè)儲(chǔ)存難題���,無(wú)數(shù)科學(xué)家也對(duì)此表現(xiàn)出濃厚的科研興趣��。研究發(fā)現(xiàn)���,在細(xì)胞核中DNA以一種非隨機(jī)的方式進(jìn)行DNA折疊,這種模式影響著許多基因組功能����,包括調(diào)節(jié)大約20,000多個(gè)基因的表達(dá)。
近日�����,英國(guó)牛津大學(xué)拉德克利夫醫(yī)學(xué)研究所Doug R. Higgs和James O. J. Davies領(lǐng)導(dǎo)的研究團(tuán)隊(duì)在Nature上發(fā)表了題為“Defining genome architecture at base-pair resolution”的文章。研究團(tuán)隊(duì)開(kāi)發(fā)了一種監(jiān)測(cè)基因組3D結(jié)構(gòu)的方法����,能在DNA單堿基對(duì)水平上精準(zhǔn)定位基因組內(nèi)的DNA互作,為基因表達(dá)��、調(diào)控的研究提供了新思路���,也為未來(lái)的基因組3D研究開(kāi)辟了無(wú)限可能����。
人類以及其他多種生物已經(jīng)進(jìn)化出精準(zhǔn)調(diào)控基因表達(dá)的復(fù)雜機(jī)制�����?��?刂苹虮磉_(dá)的核心是DNA的短調(diào)控序列,即增強(qiáng)子�。增強(qiáng)子在人體基因組中非常豐富,多達(dá)81萬(wàn)個(gè)�。增強(qiáng)子與轉(zhuǎn)錄因子相結(jié)合,轉(zhuǎn)錄因子繼而通過(guò)識(shí)別6-12個(gè)堿基對(duì)的DNA短基序(motif)來(lái)調(diào)控基因表達(dá)����。但有的增強(qiáng)子距調(diào)控基因有很長(zhǎng)的一段距離�����,這些增強(qiáng)子如何調(diào)控基因表達(dá)成為一個(gè)非常有趣且重要的研究課題���。目前獲得廣泛認(rèn)可的觀點(diǎn)是,通過(guò)DNA折疊的特定模式拉進(jìn)增強(qiáng)子和調(diào)控基因的空間距離���,使得轉(zhuǎn)錄因子能夠刺激基因表達(dá)����。
染色體構(gòu)象捕獲(3C����,chromosome conformation capture)技術(shù)徹底改變了基因組3D結(jié)構(gòu)的研究,研究人員可借助3C技術(shù)推斷不同DNA區(qū)域之間相互作用頻率�����,并發(fā)現(xiàn)增強(qiáng)子-基因的相互作用優(yōu)先發(fā)生在細(xì)胞核內(nèi)拓?fù)浣Y(jié)構(gòu)域(TADs)內(nèi)���。TAD被認(rèn)為通過(guò)拉進(jìn)基因和增強(qiáng)子的距離來(lái)解決基因邊界問(wèn)題���,從而提高增強(qiáng)子和基因匹配的概率�����。但到目前為止����,3C技術(shù)還無(wú)法在堿基對(duì)水平上確定基因和增強(qiáng)子之間的物理接觸��。為解決這個(gè)難題�,James O. J. Davies等人開(kāi)發(fā)了一種微捕獲C(Micro-Capture-C,MCC)技術(shù)��,提高了基因與增強(qiáng)子互作的監(jiān)測(cè)分辨率�。
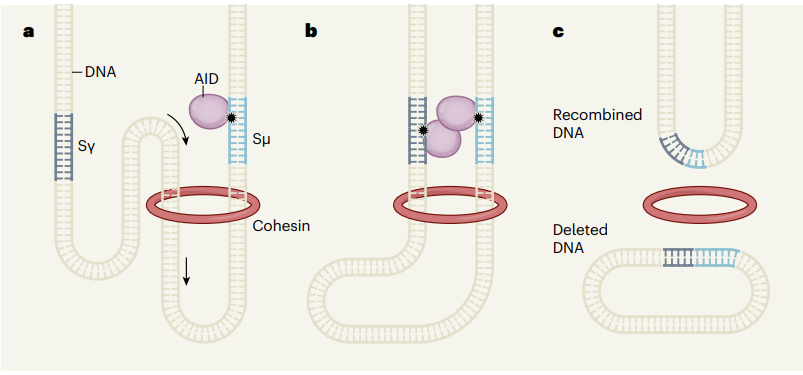
圖1.基因組折疊的環(huán)擠壓過(guò)程,圖片來(lái)源:Nature
研究人員通過(guò)對(duì)已有的3C技術(shù)進(jìn)行關(guān)鍵性的技術(shù)改進(jìn)��,顯著提高了DNA互作的識(shí)別分辨率�。據(jù)文章介紹,MCC技術(shù)使用MNase(micrococcal nuclease)核酸酶作為DNA分子剪刀�����,可實(shí)現(xiàn)隨機(jī)片段化DNA且不依賴于DNA識(shí)別序列�����,產(chǎn)生的DNA片段比序列特異性核酸酶產(chǎn)生的片段短��,因此分辨率也得以有效提高�。結(jié)果表明,MNase基本沒(méi)有堿基偏好性�,相比于壓縮緊實(shí)的DNA,MNase僅對(duì)壓縮略松的DNA(該片段有正在表達(dá)的基因)表現(xiàn)出輕微的剪切偏好性��。
圖2. DNA環(huán)擠壓導(dǎo)致CSR(class-switch recombination)基因重排�����,圖片來(lái)源:Nature
研究發(fā)現(xiàn)�����,MCC產(chǎn)生的互作DNA連接區(qū)DNA片段較短并且可以確定片段的完整序列����,意味著捕獲的基因位點(diǎn)確切位置也是已知的。因此���,MCC可以使堿基對(duì)落在DNA互作連接處��,實(shí)現(xiàn)DNA表達(dá)調(diào)控的精準(zhǔn)監(jiān)測(cè)����,實(shí)現(xiàn)染色質(zhì)捕獲的質(zhì)的飛躍。此外�����,DNA蛋白結(jié)合位點(diǎn)受到保護(hù)不會(huì)被MNase剪切����,所以該MCC技術(shù)還可以檢測(cè)到DNA結(jié)合蛋白的“足跡”。
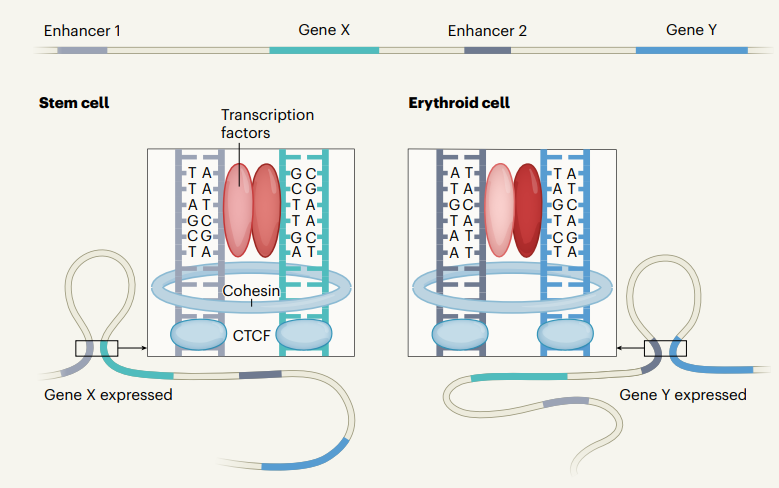
研究團(tuán)隊(duì)將MCC技術(shù)應(yīng)用于胚胎干細(xì)胞和小鼠前體紅細(xì)胞進(jìn)行三維基因組折疊研究����。值得注意的是,增強(qiáng)子����、基因和CTCF結(jié)合位點(diǎn)之間的互作區(qū)域呈現(xiàn)為高度局部化的尖峰信號(hào),與3C呈現(xiàn)的廣泛互作信號(hào)有本質(zhì)化的區(qū)別�。與既往結(jié)果一致,基因間的離散互作基本發(fā)生在TADs中(大約87%的時(shí)間)����。MCC分析結(jié)果證實(shí)����,精準(zhǔn)互作多與細(xì)胞特異性表達(dá)相關(guān)���,細(xì)胞特異性與轉(zhuǎn)錄因子的結(jié)合有關(guān)。若增強(qiáng)子-基因互作區(qū)域中心的轉(zhuǎn)錄因子結(jié)合位點(diǎn)發(fā)生突變����,MCC技術(shù)的檢測(cè)信號(hào)會(huì)出現(xiàn)局部丟失現(xiàn)象,同時(shí)檢測(cè)到基因表達(dá)下調(diào)����。以上結(jié)果提示,轉(zhuǎn)錄因子有助于維持高度特異的三維基因組折疊模式�����,這些模式參與了轉(zhuǎn)錄控制過(guò)程�。
不同類型細(xì)胞中的CTCF結(jié)合位點(diǎn)在基因組上的位置基本相同。研究人員發(fā)現(xiàn)�����,當(dāng)DNA中間區(qū)域有較多活躍轉(zhuǎn)錄基因和增強(qiáng)子時(shí)��,CTCF與DNA結(jié)合位點(diǎn)的接觸機(jī)會(huì)增加。此外���,研究發(fā)現(xiàn)cohesin和一種名為Nipbl的蛋白質(zhì)(可將cohesin裝載到DNA上)在活性基因及增強(qiáng)子處更容易富集��。這些數(shù)據(jù)支持了理論模型:當(dāng)細(xì)胞特異性的cohesin加載到活性基因和增強(qiáng)子上時(shí)�,DNA環(huán)擠壓向非細(xì)胞特異的CTCF“路障”位點(diǎn)移動(dòng)����。這一理論與既往研究非常吻合,即cohesin有助于增強(qiáng)子-基因間的相互作用����。
圖3. cohesin對(duì)于基因TAD結(jié)構(gòu)的重要性,圖片來(lái)源:Nature
MCC方法將已有技術(shù)整合為該領(lǐng)域長(zhǎng)期以來(lái)翹首以待的技術(shù):一種可以精確確定具體哪些DNA堿基在介導(dǎo)基因組遠(yuǎn)距離互作的技術(shù)方法����。這一改進(jìn)使我們能夠?qū)蛘{(diào)控過(guò)程進(jìn)行高分辨率的解析,包括多個(gè)基因和調(diào)控元件的復(fù)雜基因組區(qū)域����,以及近距離(少于20kb的DNA)增強(qiáng)子-基因間的互作。此外����,對(duì)于調(diào)控蛋白如何建立和維持3D基因組結(jié)構(gòu)的研究�����,高堿基對(duì)分辨率的MCC也將成為一種強(qiáng)有力的工具性技術(shù)�����。
1.Hua, P., Badat, M., Hanssen, L.L.P. et al. Defining genome architecture at base-pair resolution. Nature (2021). https://doi.org/10.1038/d41586-021-01494-x2.Livak F , Nussenzweig A . One ring to rule them all. Nature 575. 7782(2019).3.McCord, R. How to build a cohesive genome in 3D. Nature 551, 38–40 (2017).










 實(shí)驗(yàn)熱線:4006991663
實(shí)驗(yàn)熱線:4006991663